Здесь теория. Вы также можете перейти к выбору приборов из этого раздела.
 Гистология
Гистология 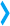
Гистология (соединение греческих слов: ἱστός — "ткань" и -λογία -logia) — это изучение микроскопической анатомии клеток и тканей растений и животных. Оно осуществляется путем изучения тонкого среза (секции) ткани под световым или электронным микроскопом. Способность визуализировать или дифференцировать микроскопические структуры часто усиливается благодаря использованию гистологических красителей. Гистология является важнейшим инструментом биологии и медицины.
Гистопатология, микроскопическое изучение пораженных тканей, является важным инструментом анатомической патологии, поскольку точная диагностика рака и других заболеваний обычно требует гистопатологического исследования образцов. Обученные врачи, часто сертифицированные как патологоанатомы, являются персоналом, который проводит гистопатологическое исследование и предоставляет диагностическую информацию на основе своих наблюдений.
Подготовленные ученые, выполняющие подготовку гистологических срезов, — это гистотехники, техники-гистологи, технологи-гистологи, ученые-медики, медицинские лабораторные техники или ученые-биомедики. Их специальность называется гистотехнологией.
Химическая фиксация с помощью формальдегида или других химических веществ.
Химические фиксаторы используются для сохранения тканей от разрушения, а также для сохранения структуры клетки и субклеточных компонентов, таких как клеточные органеллы (например, ядро, эндоплазматический ретикулум, митохондрии). Наиболее распространенным фиксатором для световой микроскопии является 10% нейтральный забуференный формалин (4% формальдегида в фосфатном забуференном физиологическом растворе). Для электронной микроскопии наиболее часто используемым фиксатором является глутаральдегид, обычно в виде 2,5% раствора в фосфатно-буферном физиологическом растворе. Эти фиксаторы сохраняют ткани или клетки в основном за счет необратимого сшивания белков. Основное действие этих альдегидных фиксаторов заключается в сшивании аминогрупп в белках посредством образования CH2 (метиленовой) связи, в случае формальдегида, или C5H10 поперечных связей в случае глутаральдегида. Этот процесс, сохраняя структурную целостность клеток и тканей, может нарушить биологическую функциональность белков, особенно ферментов, а также в определенной степени денатурировать их. Это может быть губительным для некоторых гистологических методов. Для электронной микроскопии часто используются дополнительные фиксаторы, такие как тетроксид осмия или уранилацетат.
Фиксация формалином приводит к деградации мРНК, миРНК и ДНК в тканях. Однако выделение, амплификация и анализ этих нуклеиновых кислот из фиксированных в формалине и парафинированных тканей возможны при использовании соответствующих протоколов.
Замороженный срез — это быстрый способ фиксации и монтажа гистологических срезов. Он используется при хирургическом удалении опухолей и позволяет быстро определить край (что опухоль была полностью удалена). Для этого используется холодильное устройство, называемое криостатом. Замороженная ткань нарезается с помощью микротома, замороженные срезы монтируются на предметное стекло и окрашиваются так же, как и при других методах. Это необходимый способ фиксации ткани для определенных окрашиваний, таких как окрашивание иммунофлуоресценции, связанной с антителами. Он также может быть использован для определения злокачественности опухоли, если она была обнаружена случайно во время операции у пациента.
Целью обработки тканей является удаление воды из тканей и замена ее средой, которая застывает, позволяя вырезать тонкие срезы. Биологическая ткань должна быть закреплена в твердой матрице, чтобы можно было вырезать достаточно тонкие срезы, обычно толщиной 5 мкм (микрометров; 1000 микрометров = 1 мм) для световой микроскопии и 80-100 нм (нанометров; 1 000 000 нанометров = 1 мм) для электронной микроскопии. Для световой микроскопии чаще всего используется парафин. Поскольку он не смешивается с водой, основной составляющей биологической ткани, вода должна быть сначала удалена в процессе дегидратации. Для удаления воды образцы пропускают через ванны с постепенно увеличивающейся концентрацией этанола. Затем следует гидрофобный очищающий агент (например, ксилол) для удаления спирта, и, наконец, расплавленный парафин, инфильтрационный агент, который заменяет ксилол. Парафин не обеспечивает достаточно твердой матрицы для вырезания очень тонких срезов для электронной микроскопии. Вместо него используются смолы. Эпоксидные смолы являются наиболее часто используемой средой для встраивания, но акриловые смолы также используются, особенно в тех случаях, когда требуется иммуногистохимия. Более толстые срезы (от 0,35 мкм до 5 мкм) ткани, пропитанной смолой, также могут быть вырезаны для световой микроскопии. Опять же, несмешиваемость большинства эпоксидных и акриловых смол с водой приводит к необходимости использования дегидратации, обычно этанолом.
После того как ткани обезвожены, очищены и пропитаны материалом для встраивания, они готовы к внешнему встраиванию. Во время этого процесса образцы тканей помещаются в формы вместе с жидким материалом для встраивания (таким как агар, желатин или воск), который затем затвердевает. Это достигается путем охлаждения в случае парафина и нагревания (отверждения) в случае эпоксидных смол. Акриловые смолы полимеризуются под воздействием тепла, ультрафиолетового света или химических катализаторов. Затвердевшие блоки, содержащие образцы тканей, затем готовы к секционированию.
Поскольку ткани, фиксированные в формалине и парафине (FFPE), могут храниться неограниченное время при комнатной температуре, а нуклеиновые кислоты (ДНК и РНК) могут быть извлечены из них спустя десятилетия после фиксации, ткани FFPE являются важным ресурсом для исторических исследований в медицине.
Встраивание также может быть выполнено с использованием замороженных, нефиксированных тканей в среде на водной основе. Предварительно замороженные ткани помещаются в формы с жидким материалом для встраивания, обычно это гликоль, ОКТ, TBS, криогель или смола на водной основе, которые затем замораживаются для формирования затвердевших блоков.
Секционирование может быть выполнено ограниченным количеством способов. Вертикальное сечение перпендикулярно поверхности ткани является обычным методом. Горизонтальное секционирование часто проводится для оценки волосяных фолликулов и волосяных луковиц. Тангенциальное к горизонтальному рассечение выполняется в хирургии Мооса и в методах CCPDMA.
Для световой микроскопии стальной нож, установленный в микротоме, используется для срезания участков ткани толщиной 10 микрометров, которые монтируются на предметное стекло микроскопа. Для просвечивающей электронной микроскопии алмазный нож, установленный в ультрамикротоме, используется для срезания участков ткани толщиной 50 нанометров, которые устанавливаются на медную сетку диаметром 3 миллиметра. Затем смонтированные срезы обрабатываются соответствующими красителями.
Замороженные ткани, помещенные в замораживающую среду, разрезаются на микротоме в охлаждаемой машине, называемой криостатом.
Биологическая ткань обладает малой контрастностью, присущей световому или электронному микроскопу. Окрашивание применяется для придания контраста ткани, а также для выделения определенных особенностей, представляющих интерес. В тех случаях, когда понятна основная механистическая химия окрашивания, используется термин гистохимия. Гематоксилин и эозин (окраска H&E) - это наиболее часто используемая световая микроскопическая окраска в гистологии и гистопатологии. Гематоксилин, основной краситель, окрашивает ядра в синий цвет из-за сродства к нуклеиновым кислотам в клеточном ядре; эозин, кислотный краситель, окрашивает цитоплазму в розовый цвет. Уранилацетат и цитрат свинца обычно используются для придания контрастности ткани в электронном микроскопе.
Специальное окрашивание: Существуют сотни различных других методов, которые используются для избирательного окрашивания клеток и клеточных компонентов. Другие соединения, используемые для окрашивания срезов тканей, включают сафранин, масляный красный o, красный Конго, быстрый зеленый FCF, соли серебра, а также многочисленные натуральные и искусственные красители, которые, как правило, возникли в результате разработки красителей для текстильной промышленности.
Гистохимия относится к науке об использовании химических реакций между лабораторными химическими веществами и компонентами внутри ткани. Часто используемой гистохимической методикой является реакция Перлса с берлинской лазурью, применяемая для демонстрации отложений железа при таких заболеваниях, как гемохроматоз.
Гистологические образцы часто исследуются с помощью радиоактивных методов. При авторадиографии слайд (иногда окрашенный гистохимически) просвечивается рентгеном. Чаще авторадиография используется для визуализации мест, куда радиоактивное вещество было перенесено в организме, например, клетки в фазе S (проходящие репликацию ДНК), которые включают тритированный тимидин, или участки, с которыми связываются радиомеченые зонды нуклеиновых кислот при гибридизации in situ. Для авторадиографии на микроскопическом уровне предметное стекло обычно погружают в жидкую эмульсию ядерного тракта, которая высыхает, образуя пленку для экспозиции. Отдельные серебряные зерна в пленке визуализируются с помощью микроскопии в темном поле.
Недавно были использованы антитела для специфической визуализации белков, углеводов и липидов. Этот процесс называется иммуногистохимией или, если пятно представляет собой флуоресцентную молекулу, иммунофлуоресценцией. Эта техника значительно расширила возможности идентификации категорий клеток под микроскопом. Другие передовые методы, такие как нерадиоактивная гибридизация in situ, могут быть объединены с иммунохимией для идентификации специфических молекул ДНК или РНК с флуоресцентными зондами или метками, которые могут быть использованы для иммунофлуоресценции и усиления флуоресценции с помощью ферментов (особенно усиление сигнала щелочной фосфатазы и тирамида). Флуоресцентная микроскопия и конфокальная микроскопия используются для обнаружения флуоресцентных сигналов с хорошей внутриклеточной детализацией. Цифровые камеры все чаще используются для получения гистологических и гистопатологических изображений.