 Основы твердофазного синтеза пептидов
Основы твердофазного синтеза пептидов 
Твердофазный синтез пептидов предложен Р. Б. Меррифилдом из университета Рокфеллера (Нобелевская премия 1984 г.). Этот метод основан на сборке пептида на нерастворимой полимерной подложке последовательным присоединением остатков аминокислот с защищенными α -амино- и боковыми группами. План состоял в том, чтобы собирать пептидную цепь постадийно, причем во время синтеза цепь должна быть одним концом привязана к твердому носителю. В результате выделение и очистка промежуточных и целевых производных пептидов сводились просто к фильтрованию и тщательной промывке твердого полимера для удаления всех избыточных реагентов и побочных продуктов, остающихся в растворе.
Термин твердофазный (solid-phase) относится скорее к физическим характеристикам вещества на носителе, так как химическая реакция на полимерном носителе протекает в одной фазе — в растворе. В подходящем растворителе полимер набухает, превращаясь в мало вязкий, но сильно структурированный гель (сшитые полимеры), или же растворяется (в случае не сшитых полимеров), и процесс синтеза происходит на ультрамикрогетерогенном уровне, в практически гомогенной системе.
Для твердофазного органического синтеза требуется полимерная основа — смола S, к которой прикреплен линкер L. На первой стадии к линкеру присоединяют молекулу субстрата А. Молекула А иммобилизуется (т.е. перестает быть мобильной), но сохраняет способность реагировать с другим реагентом В (стадия 2).
Продукт АВ остается на смоле, что позволяет отделить его от избытка реагента В (и побочных продуктов) простым промыванием. (Можно добавлять все новые реагенты, последовательно усложняя исходный субстрат А, главное чтобы линкер в этих реакциях оставался неизменным). Бифункциональный линкер L подбирается так, чтобы его связь со смолой S была более прочна, чем с субстратом А. Тогда на последней стадии целевое соединение AB можно отделить от смолы, разрушив его связь с линкером. Понятно, что связь L–AB должна расщепляться в мягких условиях, не повреждая ни само соединение (связь А–В), ни контакт линкера со смолой (связь L–S).

Таким образом, в идеальном случае, промывая смолу после каждой стадии и расщепляя связь с носителем, получают чистое вещество. Естественно полагать, что применение большого избытка реагентов и последующее отделение от смолы во многих случаях позволяют сдвигать химическое равновесие в сторону образования целевого продукта и сократить время синтеза. К недостаткам твердофазного органического синтеза можно отнести необходимость использования достаточно большого избытка (2—30 эквивалентов) реагентов, сложности при идентификации промежуточных продуктов синтеза, а также сравнительно высокую стоимость модифицированных полимерных носителей, которая определяется стоимостью линкера.
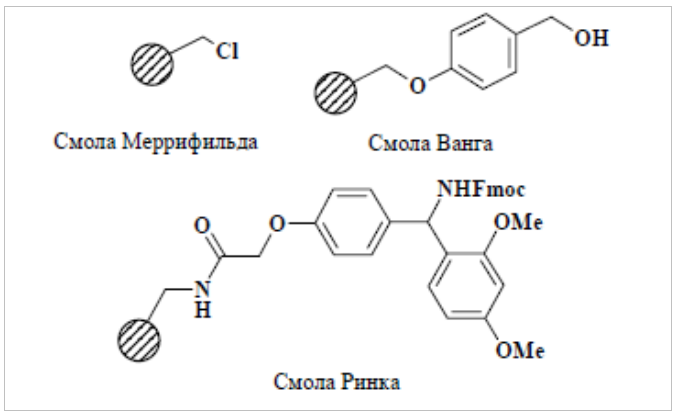
Введенный Меррифильдом в практику органического синтеза хлорметилированный полистирол (сшитый небольшим количеством дивинилбензола), так называемая смола Меррифильда, является самым доступным из полимерных носителей.
Поставленная задача требует введения полимерного носителя с привитой аминокислотой в реакцию с активированным к замещению гетероциклом. Рассмотрим подробнее методологический аспект получения иммобилизированных аминокислот на полимерных носителях.
Первой стадией нашей схемы является иммобилизация аминокислоты на полимерный носитель. Для того чтобы избежать таких побочных процессов, как образование олигопептидов, аминокислоту предварительно защищают. Как правило, используют N-защищенные аминокислоты, и образующаяся связь между аминокислотой и носителем является связью амидного или сложноэфирного типа.
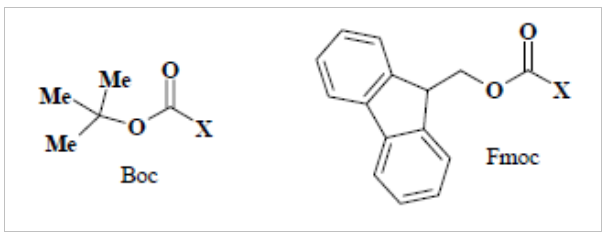
Наиболее часто применяемыми защитами аминогруппы в твердофазном органическом синтезе являются защитные группы карбаматного типа трет-бутоксикарбонильная (Boc) и 9H-флуоренилметоксикарбонильная защита (Fmoc), X — защищаемая группа:
Необходимо отметить, что выбор защитной группы определяется используемым типом полимерного носителя. Условия иммобилизации защищенных аминокислот различны для различных типов полимерных носителей. Иммобилизация Boc-аминокислот на смолу Меррифильда, представляющую собой хлорметилированный полистирол, проводится in situ в виде цезиевых солей при добавлении суспензии карбоната цезия в диметилфталате (DMF) и каталитических количеств йодида калия. Избыток реагентов по отношению к количеству носителя выбирается в каждом случае индивидуально и составляет 1,5—4 эквивалента.

Иммобилизация Fmoc-аминокислот на полимерный носитель Ванга (X=O) с образованием сложноэфирноголинкера бензильного типа осуществляется карбодиимидным методом при помощи диизопропилкарбодиимида (DIC) в присутствии 4-(диметиламино)пиридина (DMAP) в качестве катализатора. Реакция иммобилизации со стерически незатрудненными аминокислотами протекает при комнатной температуре. Иммобилизация стерически затрудненных аминокислот требует проведения реакции при 40—60 °С в течение 2-х дней и повторного проведения иммобилизации (схема 1).Иммобилизация Fmoc-аминокислот на полимерный носитель Ринка (X=NH) с образованием амидного линкера бензгидрильного типа осуществляется в присутствии реагента Кастро (1Н-1,2,3-бензотриазол-1-илокси)трис-(диметиламино)фосфония гексафторфосфата (BOP), основания диизопропилэтиламина (DIEA) и 1-гидроксибензотриазола (HOBt), в качестве катализатора. Реакция протекает при комнатной температуре в течение 2 ч для стерически незатрудненных и 4—6 ч в случае стерически затрудненных аминокислот.

На второй планируемой нами стадии (после иммобилизации защищенной аминокислоты) требуется снять защитную группу для активации аминогруппы. Способы снятия Boc- и Fmoc-защиты различны. Удаление Boc-защиты аминокислот на смоле Меррифильда проводится 50%-ной трифторуксусной кислотой в дихлорметане в течение получаса, в этих условияхлинкер Меррифильда остается неповрежденным.

После снятия защиты смолу промывают раствором триэтиламина для удаления трифторуксусной кислоты. Удаление Fmoc-защиты аминокислот на носителях Ванга (X=O) и Ринка (X=NH) проводится 20%-ным раствором пиперидина в DMF течение 40—50 мин.

Значительное уменьшение массы смолы после снятия Fmoc-защиты может служить основой для гравиметрического определения степени иммобилизации защищенных аминокислот на первой стадии твердофазного синтеза. Рекомендуется проводить последовательную обработку смолы раствором пиперидина в диметилфталате— сначала в течение 5—10 мин, затем 30 мин в свежем растворе. После снятия защиты смолу промывают не менее 4-х раз диметилфталатом для отмывки от продуктов разрушения Fmoc-защиты. Контроль за протеканием реакции ацилирования на носителе или удаление защитной функции с аминогруппы возможен с помощью теста Кайзера.
Следующим этапом, запланированным нами для практической реализации, является проведение реакции ароматического нуклеофильного замещения; нуклеофилом служит привитая аминокислота, а активированный гетероцикл находится в растворе . Большинство реакций нуклеофильного замещения наносителях по выполнению не отличаются от реакций в жидкой фазе. Следует, однако, иметь ввиду, что температура процесса не должна превышать 120 С, выше которой начинает разрушаться полистирольная основа носителя. В условиях проводимой на носителе реакции линкер также должен сохраняться.
Выбирая подходящие активированные гетероциклические субстраты, следует учитывать природу уходящей группы в гетероцикле.
Большинство линкеров при твердофазном органическом синтезе расщепляются в кислой среде. Устойчивость линкеров к кислоте резко понижается при переходе от смолы Меррифильда к смоле Ванга и Ринка. Линкер Ринка расщепляется в более мягких условиях (10—20% CF3COOH), чем линкер Ванга (50% CF3COOH).Смола Меррифильда в этих условиях пассивна, и для ее расщепления используют переэтерификацию в растворе NaOMe/MeOH, приводящую к образованию эфира кислоты.

Еще раз напомним, что природа линкера определяет тип терминальной функции в образующейся молекуле, удаляемой с подложки. Смола Ванга позволяет получать кислоты, а смола Ринка — амиды.
1. Различные исходные соединения могут быть связаны с отдельными гранулами. Затем эти гранулы смешиваются и, таким образом, все исходные соединения могут взаимодействовать с реагентом в одном эксперименте. В результате продукты реакции образуются на отдельных гранулах. В большинстве случаев, смешивание исходных в традиционной жидкой химии приводит обычно к неудачам – полимеризации или осмолению продуктов. Эксперименты на твердой подложке исключают эти эффекты.
2. Поскольку исходные материалы и продукты связаны с твердой подложной, то избыток реагентов и не связанных с подложкой продуктов можно легко отмыть от полимерной твердой подложки.
3. Можно использовать большие избытки реагентов, для того чтобы провести реакцию до конца (больше, чем 99%), поскольку эти избытки легко отделяются.
4. В случае использования низких объемов загрузок (менее 0,8 ммоль на грамм подложки) можно исключить нежелательные побочные реакции.
5. Интермедиаты в реакционной смеси связаны с гранулами и их нет необходимости очищать.
6. Индивидуальные гранулы полимера могут быть разделены в конце эксперимента и таким образом получаются индивидуальные продукты.
7. Полимерная подложка может быть регенерирована в тех случаях, когда подобраны условия разрыва и выбраны соответствующие якорные группы – линкеры.
8. Возможна автоматизация твердофазного синтеза.
Необходимыми условиями проведения твердофазного синтеза, кроме наличия нерастворимой полимерной подложки, инертной в реакционных условиях, являются: